LAS PREPARACIONES MICROSCÓPICAS DE SETAS
Para poder estudiar los diferentes componentes microscópicos característicos del género o especie de las setas que pretendemos identificar, es necesario primeramente cortar pequeñas porciones de las mismas, prepararlas o acondicionarlas y posteriormente observarlas con el microscopio.
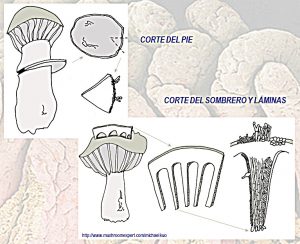
Las representaciones gráficas que se indican a continuación pretenden mostrar cuales son las principales partes de las que podemos cortar pequeñas porciones de la seta y que su posterior preparación permitirá estudiar los aspectos microscópicos más interesantes.
Las preparaciones se pueden realizar sobre ejemplares frescos recogidos recientemente o sobre material de herbario (setas secadas y no contaminadas) que requieren una posterior rehidratación y en las que una vez adquirida prácticamente de nuevo su estructura original son cortadas de idéntica forma a como se hace con los materiales frescos.
Los principales componentes microscópicos que pueden estudiarse al microscopio se encuentran en:
- EL SOMBRERO, sus principales componentes van a ser los PILEOCISTIDIOS
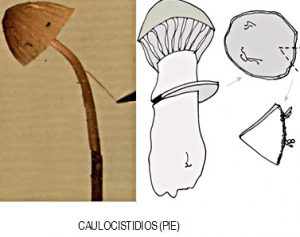
- EL PIE, los principales componentes van a ser los CAULOCISTIDIOS
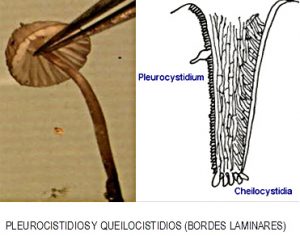
- LAS LÁMINAS, los principales componentes van a ser los PLEUROCISTIDIOS en las zonas anchas o planas de las láminas y los QUEILOCISTIDIOS en los propios vértices de las mismas. Además de los correspondientes BASIDIOS Y ESPORAS.
- ESTRUCTURAS HIFALES, PAREDES, SEPTOS, PIGMENTACIONES, ESPORAS, , van a constituir también algunos de los elementos adicionales e interesantes de estudiar mediante microscopía.
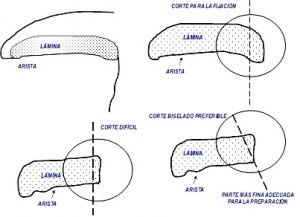
Tal y como se puede ver en las representaciones gráficas, se indican algunas de las múltiples formas de poder extraer partes del sombrero, pie y láminas, mediante cortes con cuchilla o bisturí, sobre las que posteriormente podemos estudiar los componentes microscópicos.
https://www.mushroomexpert.com/michael kuo

https://www.mushroomexpert.com/michael kuo
Una sección transversal del corte de las láminas, va a permitir estudiar su estructura interna, la TRAMA. Por otra parte, se muestra a modo orientativo como pueden diseccionarse las láminas para obtener la mejor vista de la preparación microscópica. Pensad, que este tipo de tareas, si bien no son de gran complicación para los iniciados, son un auténtico arte y requieren gran destreza que se va adquiriendo con la práctica.
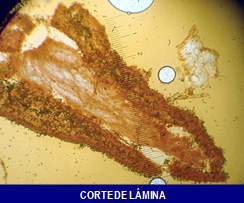
En la figura superior, puede apreciarse claramente el corte transversal de una lámina donde pueden apreciarse los extremos, vértice y trama interior de la misma.
De forma gráfica se puede ver un ejercicio práctico de las diferentes partes a cortar de una seta y la forma de realizar la preparación:

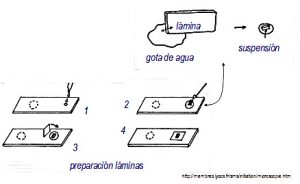
https://membres.lycos.fr/sms/initiation/microscopie.htm
UNA PREPARACIÓN MICROSCÓPICA BÁSICA PASO A PASO

https://www.mushroomexpert.com/michael kuo
En el caso de que la muestra esté seca y haya que rehidratarla, el paso previo requiere habitualmente que sea sumergida en agua dentro de una Placa Petri (tal y como se ve en la figura inferior) o en un platillo y esperar hasta que sus tejidos se hayan rehidratado completamente. En algunos casos, se requieren reactivos específicos en esta rehidratación pero esto queda para personas más expertas e introducidas en el campo de la Micología.

https://www.mushroomexpert.com/michael kuo
¿QUÉ ELEMENTOS O MATERIALES NECESITAMOS PARA LAS PREPARACIONES MICROSCOPICAS?
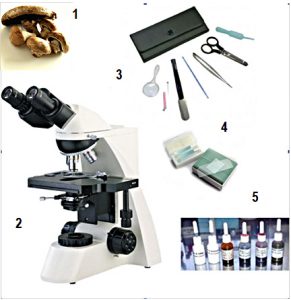
- Setas
- Microscopio óptico
- Herramientas auxiliares para preparación (lupa, tijeras, pinzas planas, aguja y alfileres de disección, cuentagotas, bisturí).
- Portaobjetos y cubreobjetos para sujeción de las preparaciones.
- Reactivos químicos y colorantes.
LA OBSERVACIÓN MICROSCÓPICA DE LAS ESPORAS
Las principales características microscópicas que se van a estudiar en las esporas van a ser:
- Coloración de la esporada (color de las láminas y deposición de las esporas desde el himenio)
- Tamaño.
- Forma
- Ornamentación.
- Reacciones químicas y teñido o tinción.
- Presencia de poro germinativo.
- Ápice o extremo superior truncado.
- Espesor de las paredes de la espora.
Fundamentalmente se ha de estudiar:
- Las esporas cuando son incoloras
- Las esporas cuando son coloreadas (Coprinus, Psathyrella, Cortinarius)
- Las esporas cuando reaccionan con el reactivo Melzer (amiloides, dextrinoides o inamiloides)
- Las esporas cuando reaccionan con el reactivo azul de algodón al lactofenol (cianófilas)
Todos estos caracteres van a permitir discriminar claramente géneros y especies.
COMO REALIZAR UNA ESPORADA
Para estudiar las esporas vía microscópica lo primero que tenemos que realizar es una esporada.
De forma resumida se dan unas instrucciones de cómo realizarla correctamente:
- Seleccionar un ejemplar maduro de una seta, evitando ejemplares jóvenes.
- Cortar la seta dejando el sombrero lo más próximo a las láminas.
- Colocar el sombrero con las láminas hacia abajo sobre la superficie que se quiere dejar la impresión de esporas (papel satinado a ser posible o mucho mejor un vidrio liso y transparente.
- Tapar el sombrero con un vaso.
- Dejar que se depositen las esporas y se sequen totalmente durante 24 horas en ambiente seco.
- Retirar con cuidado el sombrero.

Esporadas de diferentes colores de esporas
Otra forma consiste en que una vez asegurados que el ejemplar de seta es lo suficiente maduro, se recoge una porción de lámina y sobre un pequeño vidrio de reloj, se destruye con agua y lancetas de disección, una porción se deposita sobre el portaobjetos y se cubre. La visualización inicial en medio acuoso va a permitir el primer paso consistente en detectar si hay presencia de esporas en la preparación.
A partir de este paso se pueden hacer distintas preparaciones con los diferentes reactivos y colorantes habituales en este tipo de estudios
La tinción mediante reacción química de las esporas es de gran importancia, en particular con REACTIVO MELZER para ver si se vuelven azuladas (reacción AMILOIDE) o rojizas (reacción DEXTRINOIDE) o no dan ningún tipo de reacción (reacción INAMILOIDE).
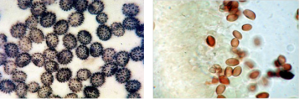
Reacción AMILOIDE Reacción DEXTRINOIDE
A su vez mediante la tinción con reactivo AZUL DE ALGODÓN AL LACTOFENOL las paredes de las esporas toman una tonalidad azul oscuro por las que se las denomina CIANÓFILAS.
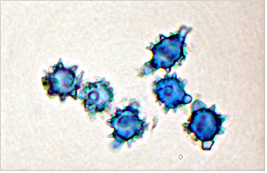
Esporas con paredes cianófilas
La mecánica a seguir puede ser la siguiente:
- Preparar distintos portaobjetos y sus respectivos cubre objetos
- Quitar una lámina de la seta, añadir unas gotas de agua y destruirla con la lanceta de disección.
- Depositar la suspensión en el portaobjetos y añadir una gota de agua destilada.
- Depositar la suspensión en otro portaobjetos y añadir una gota de reactivo Melzer.
- Depositar la suspensión en otro portaobjetos y añadir una gota de reactivo azul de algodón al lactofenol
- Depositar la suspensión en otro portaobjetos y añadir una gota de reactivo rojo Congo amoniacal
- Mover ligeramente con la aguja de la lanceta y poner el cubreobjetos.
- Observar al microscopio
Para examinar una espora se ha de tener en cuenta su posición de acuerdo al plano óptico. No es lo mismo verla de lado que frontalmente y por tanto se ha de tener en cuenta esta característica. Vistas de lado (perfil dorsi-ventral) se distingue el borde o arista interna y en el externo se ve a menudo el poro germinativo. También en la base se observa la apícula o apéndice hilar. Vista la espora de cara se puede apreciar la forma del contorno
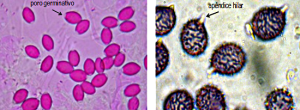
Esporas con poro germinativo Esporas con apícula o apéndice hilar
La medida de las esporas se realiza directamente desde el ocular, el cual está provisto de una escala micrométrica. Conviene medir varias esporas tanto en sentido ancho como largo y considerar un valor medio de las mismas ya que no todas tienen la misma medida ni grado de madurez o desarrollo y por esta razón se consideran que su morfología suele ser heterogénea. Una forma también habitual consiste en poner entre paréntesis las medidas máximas y mínimas medidas por lo que se puede establecer el intervalo en el que están comprendidas.
La ornamentación de las esporas es difícil de ver en microscopía óptica, va a depender en mayor o menor grado el éxito de su examen, de la resolución del microscopio, del medio adecuado y de que la ornamentación sea bastante marcada lo que favorecerá su visión. En el caso que se detecten mediante reacción, cuando la resolución sea mala, al menos las tonalidades discontinuas indicaran la presencia de esas ornamentaciones.
Aunque a continuación se muestran los principales reactivos químicos que son utilizados en los estudios microscópicos de las setas, aquí se dan algunos de los reactivos que pueden ser más útiles para el estudio de las esporas:
- Reactivo de Melzer, usado para visualizar esporas amiloides que se tiñen de gris oscuro a azul oscuro más o menos intenso, a veces sobre la totalidad de la espora y mayoritariamente sobre las verrugosidades u ornamentaciones de las esporas. Estas características son difíciles de constatar ya su intensidad no siempre es la misma y se puede ver reducida notablemente como es el caso de las Amanitas (Amanita citrina si da reacción amiloide mientras que son no amiloides en el caso de la Amanita muscaria). En otro caso el reactivo proporciona coloraciones rojizas a marrones más o menos intensas y en estos casos se dice que son dextrinoides.
- Acido sulfúrico concentrado, las esporas viran de marrón a violeta (Coprinus, Psathyrellas ).
- Azul de cresilo, colorea total o parcialmente la membrana de ciertas esporas. También permite distinguir las esporas maduras que no se colorean de las que se colorean.
- Amoniaco diluido, produce intensificación del color de ciertas esporas, concentrado puede disolver las ornamentaciones de tipo verrucoso.
REACTIVOS QUÍMICOS
De manera resumida se dan una relación de los reactivos químicos más utilizados que sirven para teñir o producir coloraciones mediante reacciones químicas en las preparaciones microscópicas y que van a permitir la identificación de los caracteres microscópicos más significativos para el reconocimiento de los principales géneros y especies de setas.
- Acetocarmin, usado para teñir basidios ( Lyophyllum, Calocybe, Tephrocybe).
- Acido Clorhidrico diluido, ( Reacción de Wieland-Meixner. Acido Clorhídrico 8N para determinar Amanita phalloides, que da una tonalidad azulada en una hoja de papel de periódico donde la lignina del papel actúa como catalizador de la reacción entre un pequeño trozo del sombrero de la seta que al ser exprimido sobre el papel le humedece y al dejarlo secar se añade sobre la mancha seca unas gotas del ácido que transcurrido un tiempo entre 10-30 minutos colorea la mancha.
- Acido nítrico concentrado y diluido, para reconocimiento de géneros (Cortinarius).
- Agua, para hidratar especies secas y para usar como medio de la preparación.
- Agua de anilina, usado para reconocimiento de géneros (Russulales).
- Acido láctico, para observar ornamentaciones de las esporas en Ascomicetos
- Acido sulfúrico concentrado y diluido, para especies de Amanitas sobre las láminas (Amanita phalloides).
- Alcohol diluido, para hidratar material seco.
- Amoniaco diluido, para hidratar material seco y usado para reconocimiento de géneros (Russula, Boletus) .
- Anilina diluida, usada para reconocimiento de géneros (Russulales).
- Anilina pura, (Reacción de Schäeffer o reacción en cruz, al trazar dos líneas en cruz sobre cutícula del sombreo de Agaricus, una línea con anilina y la otra con Acido nítrico, se considera positiva la reacción si el punto de cruce se colorea de rojo anaranjado rápidamente.
- Azul de algodón o azul de metilo al lactofenol, para observar ornamentaciones de las esporas en Ascomicetos y estructuras que se denominan cianófilas.
- Azul de anilina, para observar ornamentaciones de las esporas en Ascomicetos.
- Azul de cresilo, colorea paredes de esporas en rojo o púrpura (paredes metacromáticas típicas de Leucoagaricus, Leucocoprinus y Macrolepiota).
- Cloruro férrico, usado para reconocimiento de géneros (Cortinarius).
- Fenol, usado para reconocimiento de géneros (Russula, Cortinarius).
- Fenolanilina, usado para reconocimiento de géneros (Cortinarius).
- Formol, usado para reconocimiento de géneros (Tricholoma).
- Fuscina, usada para reconocimiento de géneros (Russula).
- Guayacol, usado para reconocimiento de géneros (Cortinarius).
- Hidróxido sódico, para hidratar especies secas y para usar como medio de la preparación.
- Hidróxido potásico diluido, para reconocimiento de géneros (Amanita, Cortinarius) y para hidratar material seco.
- Lactofenol, actúa como líquido de soporte, agente fijador y tiñe el micelio y las esporas.
- Lugol, tiñe el ápice de las ascas (Peziza).
- Nitrato de plata, usado para reconocimiento de géneros (Cortinarius).
- Reactivo de Melzer, para estudiar esporas, basidios, ascas e hifas. Se utiliza en setas con esporas hialinas o transparentes. Permite analizar el comportamiento a la reacción amiloide (coloración azul), reacción dextrinoide (coloración rojiza) o ausencia de reacción, además de permitir observar ornamentaciones de las esporas.
- Rojo Congo diluido y amoniacal, utilizado habitualmente para la mayoría de las preparaciones, fundamentalmente para ascas, hifas, basidios y cistidios, menos indicado para esporas, aunque colorea zonas internas de las esporas (endospora).
- Sulfovainillina, colorea cistidios (Russula).
- Sulfato ferroso, usado para reconocimiento de géneros (Russula, Boletus).
- Sulfoformol, usado para reconocimiento de géneros (Tricholoma, Lactarius, Cortinarius).
- Yoduro Potásico, coloraciones sobre la carne (Boletus).
Bibliografía
- http://www.mushroomexpert.com/michael kuo
- http://membres.lycos.fr/sms/initiation/microscopie.htm

